- Görüntüleme: 4K
- Cevaplar: 1
İçindekiler
Pırlanta :
Pırlanta 1 gramı: 55.000 dolarPırlanta’nın İngilizcesi olan “diamond” kelimesi Yunan dilinde "fethedilemez" anlamına gelen “adamas” kelimesinden türetilmiştir.
“Karat” kelimesi, eski çağlarda kıymetli taşları tartmak için ağırlık ölçüsü olarak kullanılan “carob”dan (keçiboynuzu tohumu) gelmektedir.
Her pırlanta çok ama çok yaşlıdır. Dinozorlar gibi tarih öncesi canlılar dahi var olmadan önceki dönemlerde oluşmuştur. En genç pırlanta 900 milyon yaşında, en yaşlısı da 3,2 milyar yaşındadır.
Elmas, insanoğlunun tanıdığı en sert doğal maddedir. Yeryüzündeki en sert madenden 58 misli daha serttir. Bir elması yalnızca başka bir elmas kesebilir.
Kesme ve cilalama sırasında her taş ortalama olarak orijinal ağırlığının yarısından fazlasını kaybetmektedir. Mücevher haline getirilen pırlantaların %5’inden daha az bir bölümü 1 karat ve daha büyüktür.
Zamanın başlangıcından beri kesilmiş olan tüm pırlantalar toplanmış olsaydı, sadece bir adet çift katlı otobüs doldurulabilirdi.
Dünyanın mücevher kalitesinde en büyük elması olan Cullinan, 1905 yılında Güney Afrika’da bulundu. Kesilmeden önce 3106 karat ağırlığındaydı (Yaklaşık bir devekuşu yumurtası büyüklüğünde).
Elmas müzayedelerinde karat başına verilen en yüksek fiyat; morumsu kırmızı renkte ve 0,95 karat ağırlığında bir elmas için ödenen 1 milyon dolardır.
Pırlanta yüzük hediye etme geleneği; 15. yüzyılda Avusturya Arşidükü Maximillian’ın, nişanı sırasında Burgonya Düşesi Mary’e elmas bir yüzük hediye etmesiyle başlamıştır.
Sol elin dördüncü parmağına yüzük takma geleneği ise, Eski Mısırlıların “vena amoris”in (aşk damarı) bu parmaktan doğrudan kalbe ulaştığına olan inançlarından gelmektedir.
Elmas ile Pırlanta Arasındaki Fark Nedir?
Pırlanta elmas madeninin belirli bir formda işlenmiş halidir. Bir başka deyişle elmas, doğandan çıktığı haliyle pırlantanın hammaddesidir. Elmas kıymetli taşlar arasında en eski olanıdır. Ülkemizde pek çok kimse, elmas ve pırlantanın iki farklı taş olduğunu zanneder, oysa ikisi de aynı taştır, yalnızca kesim şekilleri farklıdır. Bilinenin aksine, aynı kalite standartlarına sahip olan pırlanta ve elmastan; pırlanta, elmasa göre daha değerli ve pahalıdır.
Pırlanta, 1919'da Marcel Tolkowsky tarafından yaratılan kesime verilen isimdir. Bu kesimde ışık, taşın içinde kırılır ve olağanüstü bir ateş ve parlaklık vererek geri yansır. Bu brillant kesiminde, pek çok değişik biçim elde etmek mümkündür. Ancak, 57 yüzeyli yuvarlak kesim, en çok kullanılan kesimdir. Fantazi kesim olarak adlandırılan diğer kesimler; oval, damla, prenses, markiz, oktagon, kalp ve baget gibi kesimlerdir.
Ülkemizde elmas kesim olarak bilinen kesim, dünyada gül kesim diye bilinir. Bu kesim, Türkiye'de yaygın olarak kullanılmış ve nesilden nesile aktarılmıştır. Antik tasarımlı mücevherlerde görülen gül kesimin altı düzdür. Bu kesimin 12 ile 37 arasında değişen cilalı yüzeyi (faset) vardır. Elmasa çarpan ışık sadece yüzeyden yansıdığı için, pırlantadan fışkıran ateş ve parlaklık gül kesimde bulunmaz.
Pırlanta yani işlenmemiş haliyle elmas orijinal olarak yalnız kimberlit kayalarında bulunur. Diğer kayalarda bulunan elmaslar ise büyük oranda kimberlitten aşınmalarıyla ya da tortuların başkalaşım geçirmeleriyle meydana gelmiştir. Elmasın en çok bulunduğu yerler olarak, Güney Afrika (Kimberley’de), Güney Amerika, Endonezya ve Hindistan gösterilebilir.
Pırlanta elmasın işlenmiş halidir. Pırlanta üzerinde 57 faset bulunur. Faset, ışığı yansıtan açılı yüzeylere verilen isimdir. Pırlanta üç bölümden oluşur. Bu bölümler taç, kemer ve külahtır. Kemerin üstünde bulunan bölüme “Taç” denir. Taç bölümünde 33 adet faset bulunur. Taç bölümünde bulunan fasetlerin sayısı fazla olduğu için, bu bölümde daha fazla yansıma ve parlaklık gözlemlenir. Bundan dolayı taç bölümü, pırlantanın geneline göre daha beyaz görünür.
“Kemer” bölümü doğal, cilalı ya da fasetli olabilir. Kemer kalınlığı pırlantanın parlaklığını etkiler. Kalın kemerli bir pırlanta daha mat görünür, ince kemerli pırlanta ise mıhlamaya karşı dayanıksız olur. Kemer, pırlantayı sağlam tutan önemli bir bölümdür. Kemer olmasaydı, pırlanta üretimde kullanılamazdı.
Kemerin altında bulunan bölüme “külah” denir. Külah’ta 24 faset vardır. Külah pırlantaya giren ışığın dışarı yansımasını sağlar. Külah ne kadar doğru açıyla kesilmiş ise, pırlantaya giren ışık yansıyarak yine taçtan çıkar. Böylece pırlantada optimum parlaklık sağlanmış olur .Kimi zaman külah ucuna da faset atılabilir. Bu faset ile pırlantanın en hassas kısmı olan külah ucunda oluşabilecek hasarlar önlenmiş olur. Dünyanın en sert madeni olsa da, pırlanta belirli yönlerden gelen darbelere karşı dayanıksızdır ve çabucak kırılabilir.
kaliforniyum 252 :
Kaliforniyum 1 gramı: 27 milyon dolarKaliforniyum, sembolü Cf ve atom numarası 98 olan radyoaktif metalik bir kimyasal elementtir. İlk kez Şubat 1950'de Kaliforniya Üniversitesi, Berkeley'deki laboratuvarda küriyumun alfa parçacıkları (helyum iyonları) ile bombardıman edilmesiyle üretildi. Aktinit serisinin dokuzuncu üyesi ve sentezlenen altıncı uranyum ötesi elementtir. Yüksek atom ağırlığına sahip elementler içinde, aynştaynyumun ardından çıplak gözle görülebilecek miktarı üretilebilen ikinci elementtir. Element, keşfedildiği Kaliforniya Üniversitesi ve Kaliforniya eyaletinin onuruna bu şekilde isimlendirildi.
Kaliforniyum normal basınç altında biri 900 °C'nin üstünde ve diğeri 900 °C'nin altında olmak üzere iki farklı kristal yapıda bulunur. Yüksek basınçta üçüncü bir kristal yapı söz konusudur. Kaliforniyum oda sıcaklığında hava ile temas ederse yavaşça matlaşır. Bilinen yirmi izotop içinde kaliforniyum-251 898 yıllık yarı ömrü ile elementin en kararlı izotopudur. Bu kısa yarı ömür elementin yerkabuğunda bulunmadığı anlamını da taşır. Yarı ömrü 2,64 yıl olan kaliforniyum-252 en yaygın olarak kullanılan izotoptur ve ABD'de Oak Ridge Ulusal Laboratuvarı'nda ve Rusya'da da Atom Reaktörleri Araştırma Enstitüsü'nde üretilmektedir.
Kaliforniyum pratik uygulaması olan birkaç uranyum ötesi elementten biridir. Bu uygulamaların çoğunda belli başlı kaliforniyum izotoplarının nötron yayma özelliğinden faydalanılır. Örneğin nükleer reaktörlerin başlatılmasında kaliforniyum kullanılabilir. Ayrıca nötron saçılması ve nötron spektroskopisiyle madde araştırmalarında da nötron kaynağı olarak kullanılır. Bunların dışında kaliforniyum daha yüksek atom ağırlığına sahip elementlerin sentezinde de kullanılır: ununoktiyum (118. element) kaliforniyum-249 atomunun kalsiyum-48 iyonları ile bombardıman edilmesiyle sentezlendi. Kaliforniyumun kullanımı esnasında radyolojik endişeler de dikkate alınmalıdır. Ayrıca elementin iskelet dokudaki biyoakümülasyonu kırmızı kan hücrelerinin oluşumunu bozar.
Özellikleri : 98 atom numaralı kaliforniyum, periyodik tabloda aktinitler serisinde yer alır. Öncesinde berkelyum ve ardında da aynştaynyum yer alır. Lantanitler serisindeki yapısal analogu disprozyumdur.
Fiziksel özellikleri : Kaliforniyum, erime noktası 900 ± 30 °C ve kaynama noktası tahmini 1745 °C olan radyoaktif, gümüşi beyaz renkli, aktinit bir metaldir. Saf metal haldeyken yumuşaktır ve jilet ile kolayca kesilebilir. Kaliforniyum metali 300 °C'nin üstünde vakuma maruz kaldığında buharlaşmaya başlar. 51 K'nin (−220 °C) altında kaliforniyum metali ferromanyetik veya ferrimanyetiktir (mıknatıs gibi davranır), 48 ve 66 K arasında antiferromanyetiktir (bir ara durum) ve 160 K'nin (−110 °C) üzerinde paramanyetiktir (dış bir manyetik alan ona mıknatıslık kazandırır). Kaliforniyum lantanit metalleri ile alaşım oluşturabilir, ancak bu konuda çok az şey bilinmektedir.
Element 1 standart atmosfer basıncı altında iki farklı kristal yapıya sahiptir: çift-hegzagonal sıkı paket (hsp veya dhcp) yapılı alfa (α) ve yüzey merkezli kübik (ymk veya fcc) yapılı beta (β). α formu 900 °C'nin altında ve 15,10 g/cm³ yoğunlukla görülür, β formu da 900 °C'nin üstünde ve 8.74 g/cm³ yoğunlukla görülür. 48 GPa basınçta, atomun 5f elektronlarının dekolizasyonu sonucunda β formu ortorombik kristal sisteme dönüşür.
Bir malzemenin bulk modülü, malzemenin eş dağılımlı bir basınca karşı direncininin ölçüsünü ifade eder. Kaliforniyumun bulk modülü 50 ± 5 GPa'dır. Bu sayı üç değerli lantanit metallerinkine yakınken alüminyum (70 GPa) gibi daha bilindik metallerinkinden küçüktür.
Kimyasal özellikleri ve bileşikleri : Kaliforniyum 4, 3 ve 2 değerliklerini gösterir. Bu sayılar bu elementin bir atomunun yapabileceği kimyasal bağ sayısını belirler. Kimyasal yapısı diğer -öncelikli- 3+ değerlikli aktinit elementleri ve periyodik tabloda kaliforniyumun üstünde bulunan lantinit elementi disprozyum ile benzerlik gösterdiği tahmin edilmektedir. Element oda sıcaklığında hava ile temas ederek yavaşça kararır ve matlaşır, ortama nem eklenirse kararma oranı da artar.
Kaliforniyum hidrojen, azot veya kalkojen (oksijen grubu elementi) ile ısıtıldığında tepkimeye girer. Kuru hidrojen ve sulu mineral asitleriyle girdiği tepkimeler hızlıdır.
Kaliforniyum sadece, kaliforniyum(III) katyonu halindeyken suda çözünebilir. +3 iyonunu çözeltide indirgeme veya oksitleme çalışmaları başarısız olmuştur. Element suda çözülebilir, klorür, nitrat, perklorat ve sülfat oluşturur.
İzotopları : Kaliforniyumun tanımlanan yirmi radyoizotopu bulunmaktadır. En kararlı olan kaliforniyum-251'in yarı ömrü 898 yıl, kaliforniyum-249'un 351 yıl, kaliforniyum-250'nin 13,08 yıl ve kaliforniyum-252'nin 2,645 yıldır. Geriye kalan izotopların tamamının yarı ömrü bir yıldan kısa ve bunların çoğunun yarı ömrü de 20 dakikadan daha kısadır. Kaliforniyumun izotoplarının kütle numaraları 237 ile 256 arasındadır.
Kaliforniyum-249 berkelyum-249'un beta bozunumu ile üretilir ve diğer kaliforniyum izotoplarının çoğu berkelyumun bir nükleer reaktörde yoğun nötron radyasyonuna maruz bırakılmasıyla üretilir. Kaliforniyum-251 en uzun ömürlü izotop olmasına rağmen, nötron toplama (yüksek nötron yakalama) eğilimi ve diğer parçacıklarla etkileşime girme (yüksek nötron tesir kesiti) eğilimi sebebiyle, üretim verimi %10'dur.
Kaliforniyum-252 çok güçlü bir nötron yayıcıdır. Bu sebeple son derece radyoaktiftir ve zararlıdır. Zamanının %96,9'sında alfa bozunumu ile (iki proton ve iki nötron kaybederek) küriyum-248'i oluşturur, geriye kalan %3,1'de kendiliğinden fisyona uğrar. Bir mikrogram (µg) kaliforniyum-252 saniyede 2,3 milyon nötron yayar. Kendiliğinden fisyon başına ortalama ise 3,7 nötrondur. Yarı ömrü 60,5 gün olan kaliforniyum-254 izotopu yalnızca kendiliğinden fisyon yoluyla bazonur. Diğer kaliforniyum izotoplarının çoğu da alfa bozunumu yoluyla küriyum (atom numarası 96) izotoplarına dönüşür.
Tarihi: Kaliforniyum ilk kez 9 Şubat 1950'de (veya o civarlarda) Kaliforniya Üniversitesi, Berkeley'de Stanley G. Thompson, Kenneth Street, Jr., Albert Ghiorso ve Glenn T. Seaborg tarafından sentezlendi. Takım o güne kadar keşfedilen altıncı uranyum ötesi elementin keşfini 17 Mart 1950'de duyurdu.
Kaliforniyumun elde edilebilmesi için bir mikrogram ölçüsündeki küriyum-242 (24296Cm) hedefi, Berkeley, Kaliforniya'daki 1.500 mm yarıçaplı siklotronda 35 MeV enerjili alfa parçacıkları (42He) ile bombardıman edildi. Bunun sonucunda kaliforniyum-245 (24598Cf) ve bir de serbest nötron elde edildi.
Bu deneyde sadece 5.000 kaliforniyum atomu üretilebilmişti ve bu atomların yarı ömürleri 44 dakikaydı.
Kaşifler elementi Kaliforniya ve Kaliforniya Üniversitesi'nin onuruna kaliforniyum olarak isimlendirdiler. Bu element 95, 96 ve 97'nin isimlendirilmesinde kullanılan alışılmış yöntem için bir kırılma teşkil ediyordu. Bu elementlerin isimlendirilmesinde periyodik tabloda bir üstlerinde yer alan elementler için kullanılan yöntem uygulanmıştı. Altıncı periyotta 95. elementin hemen üzerinde yer alan evropiyum, adını keşfedildiği kıtadan aldı, bunun üzerine 95. element de amerikyum olarak isimlendirildi. 96. element, hemen üstünde yer alan ve bilim adamı ve mühendis Johan Gadolin'in onuruna isimlendirilen gadolinyuma benzer şekilde, Marie Curie ve Pierre Curie'nin onuruna küriyum olarak isimlendirildi. Terbiyum keşfedildiği şehrin adını aldı, 97. element de aynı şekilde keşfedildiği şehire atfen berkelyum olarak isimlendirildi. Ancak 98. elementin üstünde yer alan disprozyum basitçe "ulaşması zor" anlamına geliyordu, bu yüzden araştırmacılar bu gayri resmi adlandırma anlaşmasını bir tarafa bırakmaya karar verdiler.
Tartılabilecek miktarda kaliforniyum üretimi ilk kez Idaho Ulusal Laboratuvarı'ndaki Malzeme Test Reaktörü'nde plütonyum hedeflerin radyasyona maruz bırakılmasıyla gerçekleştirildi ve bu bulgular 1954'te rapor edildi. Kaliforniyum-252 izotopunun yüksek kendiliğinden fisyon oranı da bu numunelerde gözlendi. Konsantre şekilde kaliforniyum üzerindeki ilk deneyler 1958'de yapıldı. Kaliforniyum-248'den -252'ye kadar olan izotplarda aynı yıl, bir nükleer reaktörde beş yıl süreyle radyasyona maruz bırak plütonyum-239 numunesinden elde edildi. İki yıl sonra 1960'ta Kaliforniya Üniversitesi Lawrence Radyasyon Laboratuvarı'ndan Burris Cunningham ve James Wallman, kaliforniyumu buhar ve hidroklorik asit ile işleyerek ilk kaliforniyum bileşikleri olan kaliforniyum triklorür, kaliforniyum oksiklorür ve kaliforniyum oksiti yarattılar.
1960'larda Oak Ridge, Tennessee'de bulunan Oak Ridge Ulusal Laboratuvarı'ndaki (ORNL) Yüksek Akılı İzotop Reaktörü'nde (HFIR) toplu halde kaliforniyum üretimine başlandı. 1965'ten beri HFIR nominal olarak yılda 500 miligram kaliforniyum üretmektedir. 1958 Amerika Birleşik Devletleri-Birleşik Krallık Ortak Savunma Antlaşması uyarınca Birleşik Krallık'tan sağlanan plütonyum, kaliforniyum üretimi için kullanıldı.
1970'lerin başlarında ABD Atom Enerjisi Komisyonu endüstriyel ve akademik tüketicilere mikrogramı 10 dolar olmak üzere kaliforniyum-252 satışı yapmıştı ve 1970'ten 1990'a kadar yer yıl ortalama 150 mg kaliforniyum-252 sevkiyatı yapıldı. Kaliforniyum metali ilk kez 1974'te Haire ve Baybarz tarafından californium(III) oksitin lantan metaliyle indirgenmesi sonucunda elde edildi. Sonuçta mikrometrenin altında bir kalınlıkta mikrogram miktarlarda ince filmler elde ettiler.
Varlığı : Bilindiği kadarıyla kaliforniyum yeryüzünde doğal olarak bulunmamaktadır. Ancak çeşitli nükleosentezlerin meydana gelmesi sebebiyle uranyum cevherlerinde birkaç dakikalığına da olsa varlığını sürdürebilmesi olasıdır. Mineral araştırmalarında ve tıbbi tedavilerde kaliforniyumu kullanan tesislerin yakınlarında eser miktarlarda kalifornuyum bulunabilir. Element oldukça çözünmez bir görünüm sergiler ancak, çözelti içindeki katı parçacıklara bağlanır; katı parçacıklardaki yoğunluğu katı parçacıkları çevreleyen sudaki yoğunluğundan 500 kat fazla olabilir.
1980 öncesinde havada yapılan nükleer silah denemelerinin sebep olduğu nükleer serpintiler çevredeki kaliforniyum miktarına küçük bir miktar katkı yaptı. Bir nükleer patlama sonrasında havadan alınan numunelerde kütle numaraları 249, 252, 253 ve 254 olan kaliforniyum izotopları gözlemlendi. Kaliforniyum büyük miktarlarda üretilmediğinden ABD Enerji Bakanlığı'nın miras bölgelerindeki başlıca radyoaktif çekirdekler arasında yer almaz.
Üretimi : Kaliforniyum nükleer reaktörlerde ve parçacık hızlandırıcılarda üretilir. Kaliforniyum-250, berkelyum-249'un (24997Bk) nötron ile bombardıman edilmesiyle başlayan bir süreç sonrasında elde edilir. Berkelyum-249'un nötron yakalaması (n,γ) yoluyla berkelyum-250 (25097Bk) oluşur, berkelyum-250 hızlıca beta bozunumuna (β−) uğrayarak kaliforniyum-250'ye (25098Cf) dönüşür.
Güvenlik : İskelet dokuda biriken kaliforniyum, radyasyon yayarak vücudun kırmızı kan hücresi üretme kabiliyetini bozar. Element yüksek radyoaktifliği ve doğada düşük yoğunlukta bulunması sebebiyle herhangi bir organizma üzerinde doğal biyolojik bir rol oynamaz.
Kaliforniyum vücuda kontamine yiyecek veya içeceklerin sindirilmesiyle veya elementin asılı kaldığı havanın solunmasıyla girebilir. Vücuda girmesinin ardından kaliforniyumun sadece %0,05'i kan dolaşımına karışır. Yaklaşık %65'i iskelette, %25'i karaciğerde birikir geri kalanı da ya diğer organlarda birikir ya da, büyük oranda idrarla olmak üzere, dışarı atılır. İskelet ve karaciğerde biriken kaliforniyumun yarısı sırasıyla elli ve yirmi yılda gider. İskeletteki kaliforniyum kemik boyunca yayılmadan önce kemik yüzeyine bağlanır.
Elementin vücuda alınması en tehlikeli durum olmakla birlikte, kaliforniyum-249 ve kaliforniyum-251 gama ışınımı yoluyla vücut dışından da doku yıkımına sebep olabilir. Kemikte ve karaciğerde kaliforniyumun saldığı iyonize radyasyon kansere sebebiyet verebilir.
Antimatter (Antimadde)
Antimatter (Antimadde) 1 gramı: 62 trilyon dolarAntimadde antiparçacıklardan oluşan maddedir. Antiparçacıklar ise normal maddenin yapı taşları olan parçacıklarla aynı kütleye fakat zıt işaretli ama aynı büyüklükte kuantum sayılarına, örneğin elektrik yüküne sahip parçacıklardır. Maddeyi oluşturan tüm parçacıkların temel parçacık olsun ya da olmasın bir antiparçacığı vardır. Örneğin temel bir parçacık olan elektronun antiparçacığına pozitron denir. Bu antimadde parçacığı elektron ile aynı kütleye sahiptir; fakat elektrik yükünün işareti elektron gibi eksi değil artıdır. Protonun ve nötronun antiparçacıklarına ise antiproton ve antinötron denir. Bu parçacıklar da normal proton ve nötron ile aynı kütleye sahiptir; ama elektriksel yükleri zıt işaretlidir.
Normal parçacıkların normal maddeyi oluşturmasına benzer biçimde antiparçacıklar bir araya gelerek antimaddeyi oluşturur. Örneğin bir antiprotonun ve bir pozitronun bir araya gelmesiyle normal hidrojenin antimaddesi olan antihidrojen oluşur. Kuramsal olarak bütün diğer antimadde atomlarının da oluşmasının önünde bir engel yoktur. Ancak helyumdan daha büyük antimadde atomları bugüne kadar ne laboratuvar ortamında üretilebilmiş ne de evrende gözlemlenebilmiştir.
Madde ve antimadde parçacıkları bir araya geldiği zaman birbirlerini yok eder ve E=mc2 formülüne göre enerjiye dönüşür. Bu sürecin tersi de mümkündür. Yani yeterli miktarda enerjiden madde-antimadde çifti oluşabilir.
Kuyruklu Yıldız tozu
Kuyrukluyıldız tozu: "Stardust" uydusunun uzayda "Wild II" adlı kuyrukluyıldızdan topladığı tozun gramı 28 milyar euroKozmik toz, uzayda var olan bir tozdur. Kozmik toz parçacıklarının çoğu boyutları 0,1 mikrometreye ulaşan az miktardaki moleküller topluluğudur. Uzaydaki tüm tozun küçük bir kısmı yıldızların bıraktığı yoğunlaşmış maddeler gibi daha büyük ateşe dayanıklı mineraller içerir. Buna yıldıztozu denir ve yıldıztozundan alttaki ayrılmış bölümde ayrıca bahsedilmiştir. Yerel yıldızlararası ortam olan Local Bubble'ın toz yoğunluğu ortalama 10-6 x toz parçacığı/m³ 'tür ve her toz parçacığı yaklaşık 10–17 kg'lık bir kütleye sahiptir.
Kozmik tozlar, astronomik konumlarına göre ayırt edilebilirler: galaksilerarası toz, yıldızlararası toz, gezegenlerarası toz (örneğin: zodyak bulutu), ve uydusal toz (örneğin: gezegen yüzüğü). Güneş sisteminde gezegenlerarası toz zodyak ışıklarının oluşmasına sebep olur. Güneş sisteminin toz kaynakları arasında kuyruklu yıldız tozları, asteroid tozları, Kuiper kuşağından gelen toz ve Güneş sistemi üzerinden geçen yıldızlararası toz bulunur. Terminoloji dünya üzerine açıkça düşen toz haricinde dünya üzerinde bulunan materyalleri tanımlamak için özel kullanımlar barındırmaz. Bir hesaplamaya göre, her yıl yaklaşık olarak 40,000 ton kozmik toz dünya yüzeyine ulaşmakta. Ekim 2011'de, bilim adamları kozmik tozun yıldızlar tarafından doğal olarak ve hızlıca yaratılabilen karmaşık organik maddeler(aromatik-yağlı yapıda amorf organik katılar) içerdiğini rapor etti.
14 Ağustos 2014'te, bilim adamları Stardust uzay aracı tarafından 2006'da dünyaya dönüşüne kadar toplanmış olan olası yıldızlararası uzay parçacıkları kolleksiyonunu duyurdu.
Çalışmalar ve önemi : Kozmik toz astronomlara önceden yalnızca gözlemleri sırasında cisimleri karartan bir engel gibi görünürdü. Kızıklötesi astronomi başladığında, bu toz parçacıkları astrofiziksel gelişimin büyük ve hayati bir elemanı olarak gözlendi. Bu parçacıkların analizi bize, bizim güneş sistemimizin oluşumu gibi fenomenler hakkında bilgi verebilir. Örneğin, kozmik toz bir yıldız ömrünün sonuna yaklaştığındaki kütle kaybını yönlendirebilir, yıldız oluşumunun erken safhalarında rol oynar, ve gezegenleri oluşturur. Bizim güneş sistemimizde toz; zodyak ışıklarının oluşumunda, Satürn'ün B halkasının desenlerinin oluşumunda, Jüpiter, Satürn, Uranüs ve Neptün gezegen halkalarının dış yayılımında ve kuyruklu yıldızların oluşumunda büyük rol oynar.
Toz ile ilgili çalışmalar farklı bilimsel alanları bir araya getiren çok yönlü araştırmalardır: fizik (katıhal fiziği, elektromanyetik teori, yüzey fiziği, istatistiksel fizik, termal fizik), oransal matematik, kimya (tanecik yüzeylerde kimyasal reaksiyonlar), meteor bilimi, aynı zamanda astronomi ve astrofiziğin her dalı. Bu apayrı araştırma alanları takip eden ana fikirle bir araya getirilebilir: kozmik toz parçacıkları periyodik olarak, kimyasal olarak, fiziksel olarak ve dinamik olarak değişir. Evrenin materyal geri dönüştürdüğü dış yoldaki toz izlerinin evrimi, süreçlerinde birçok insana tanıdık gelen günlük geri dönüşüm adımlarıyla benzerlik gösterir: üretim, depolama, geliştirme, toplama, tüketme ve ayırma. Farklı bölgelerdeki kozmik tozun gözlem ve ölçümleri Evrenin geri dönüşüm süreçlerine önemli bir bakış açısı sağlar: yayılan yıldızlararası ortam bulutlarında, moleküler bulutlarda, genç yıldız objelerin yıldızetrafı tozlarında ve Güneş sistemimiz gibi gezegen sistemlerinde, astronomlar tozun en üst geri dönüşüm evresinde olduğunu varsayarlar. Astronomlar tozun farklı yaşam evrelerindeki gözlemsel anlık fotoğraflarını bir araya getirerek, zamanla, evrenin karmaşık geri dönüşüm adımlarını tamamlayan bir film haline getirirler.
Kozmik toz noktalarının başka alanlardaki kozmik toz araştırmalarındaki tespiti: toz fotonlar gibi hareket eder. Kozmik toz bir kez saptandığında, çözülmesi gereken bilimsel problem hangi süreçlerin bu dizgileşmiş foton benzeri objeyi (tozu) dedektöre getirdiğini belirleyen ters süreci oluşturmaktır. Parçacığın anlık hareketi, materyal özellikleri, araya karışmış plazma ve manyetik alan gibi değişkenler toz parçacığının gelişi esnasında toz dedektöründe belirlenir. Bu değişkenlerden herhangi birindeki en ufak bir değişim tamamen farklı bir toz dinamik davranışı verebilir. Bu nedenle herhangi biri bu objenin nereden geldiği ve geçtiği ortamlarda neler olduğu hakkında bilgi alabilir.
Tespit yöntemleri : Kozmik toz, tozun ışınımsal özelliklerinin değerlendirilmesi ile dolaylı yoldan tespit edilebilir.
Kozmik toz ayrıca direkt olarak toplanma metodlarının ve toplanma bölgelerinin çeşidine göre de tespit edilebilir. Dünya atmosferine giren dünya dışı materyallerin 5 ile 300 ton arasında olduğu tahmin edilmektedir. Dünyaya düşen toz parçacıkları dünya atmosferinde: stratosferde uçan NASA Uçaklarının kanatlarında, dünyadaki geniş buz kütlelerin yüzey çöküntülerinde(Antarktika ve Grönland/ Buzullar) ve derin okyanus çökeltilerinde toplanır. 1970'lerin sonunda Seattle'da bulunan Washington Üniversitesi'ndeki Don Brownlee toplanmış toz parçacıklarının dünya dışı doğalarını ilk kez kesin biçimde tanımladı. Diğer kaynak ise içlerinde yıldıztozu içeren meteoritlerdir. Yıldıztozu tanecikleri güneş öncesi yıldızların ısıya dayanıklı katı parçacıklarıdır. Bu tanecikler sadece gelişmiş yıldızlarda olabilen yıldızlararası ortamla karışım öncesi olan aşırı izotopik yapılarıyla bilinirler. Bu tanecikler yıldızdan ayrılıp soğurlarken yıldızsal maddeden daha yoğun bir hal alırlar.
Gezegenlerarası uzayda, uzay araçlarına toz dedektörleri inşa edildi ve bu araçlar uçuruldu. Bazıları hala uçmakta ve bundan fazlası halihazırda uçurulmak için inşa edilmekte. Gezegenlerarası uzaydaki toz parçacıklarının büyük orbital hızları(sıklıkla 10–40 km/s) dokunulmamış parçaları yakalamada sorun yaratır. Bunun yerine, olay yerindeki toz dedektörleri genel olarak toz parçacıklarının araç üzerindeki yüksek hız etkileri ile ilgili değişkenleri hesaplamak üzere tasarlanmıştır ve bu sayede parçacıkların fiziksel özelliklerini (genellikle kütle ve hız) genellikle laboratuvar ayarlamalarına göre (örneğin: bilinen değerlerle ivmelendirilmiş parçacıkları toz dedektörlerinin laboratuvar kopyasıyla etkileştirmek) türetirler. Yıllar boyunca toz dedektörleri ışık parlamalarının etkisi, akustik sinyal ve iyonlaşma etkisi arasında ölçümler yaptı. Şu anda Stardust'daki toz aygıtı daha önce keşfedilmemiş düşük yoğunluklu aerojel parçacıklar yakaladı.
Daha önce HEOS-2, Helios, Pioneer 10, Pioneer 11, Giotto ve Galileo uzay görevlerinde uçan toz dedektörleri, Dünya yörüngesindeki LDEF, EURECA va Gorid uyduları ve bazı bilim adamları Voyager 1 ve 2 uzay araçlarını direkt olarak kozmik toz örneği alabilmek için dev bir Langmuir sondası gibi kullandılar. Halen toz dedektörleri Ulysses, Cassini, Proba, Rosetta, Stardust ve New Horizons uzay araçlarının üzerinde uçmaktalar. Dünya üzerinde ya da uzayın derinliklerinde toplanan ve örnek getirme görevlerinden geri getirilen toz daha sonra tüm dünyadaki toz bilim adamları tarafından kendi laboratuvarlarnda analiz edilir. NASA Houston JSC'de kozmik toz için geniş bir saklama tesisi bulunmaktadır.
Kızılötesi ışık kozmik toz bulutlarının içinden geçebilir. Bu durum bizim yıldız oluşum bölgelerini ve galaksi merkezlerini irdelememize olanak sağlar. NASA'nın Spitzer Uzay Teleskopu uzaya fırlatılmış en büyük kızılötesi teleskoptur. Spitzer Uzay Teleskopu(önceden SIRTF, kızılötesi uzay teleskop tesisi) 25 Ağustos 2003'te Canaveral, Florida'dan Delta roketi tarafından uzaya fırlatıldı. Görevi boyunca Spitzer, kızılötesi enerjiyi ya da 3-180 mikrometre dalga boyunda ışınım yapan objelerdeki ısıyı saptayarak spektrum ve resimler elde edecek. Bu kızılötesi ışınımın çoğu Dünya atmosferi tarafından engellenir ve yeryüzünden gözlemlenemez. Spitzer tarafından yapılan bulgular çoktan kozmik toz üzerindeki çalışmalara yeni bir boyut kattı. Bir Spitzer takımından gelen son rapor kozmik tozun süper kütleli kara deliklerin yakınında oluştuğuna dair bazı kanıtlar sunuyor.
Bir diğer tespit mekanizması da polarimetridir. Toz parçacıkları küre şeklinde değillerdir ve yıldızlararası manyetik alan düzleminde sıralanmak isterler, toz bulutlarından geçen yıldız ışığını polarize etmeyi tercih ederler. Kozmik kızarmanın fark edilebilecek kadar hassas olmadığı yakın yıldızlararası uzayda yüksek hassasiyetli optik polarimetri Local Bubble'daki toz yapılanmasını incelemek için kullanılır.
Beyaz Tüfe Mantarı
Beyaz trüffe mantarı 1 gramı : 80 EuroTrüf mantarı, ağaç köklerinde toprağın altında yetişen yenilebilir mantar türüdür. Tek çeşit bir mantar türü olmayıp toprak altında yetişen mantarlara genel olarak trüf mantarı adı verilir. Yenilebilir mantar türlerinin içinde en lezzetli mantarlardan bazıları trüf mantarının farklı çeşitleri olup özellikle İtalya, Fransa ve İspanya’da bolca tüketilir.
Halk arasında domalan mantarı veya keme olarak da bilinen trüf mantarının en lezzetli ve değerli çeşidi Tuber magnatum adı verilen beyaz trüf mantarıdır.
Trüf Mantarı Özellikleri : Trüf mantarının dışı sert bir kabukla kaplıdır. Bu kabuk lezzetinin bozulmaması için pişirme sırasında değil pişirildikten sonra servis yaparken soyulur. Trüf mantarı olgunlaştığında ceviz büyüklüğünde ve yaklaşık 100 gr ağırlığında olur. En lezzetli tadı bu ölçülere ulaştığında verir ancak portakal büyüklüğü ve 1 kilogram ağırlığa kadar ulaşabilirler.
Diğer tüm mantarlar gibi ağırlığının çoğu sudan oluşur ve beklediğinde aromasını ve suyunu kaybettiği için taze kullanılmalıdır. Trüf mantarının gerçek tadını almak için toplandıktan sonra beş gün içinde tüketilmesi tavsiye edilir. Trüf mantarı kesinlikle kurutulmamalıdır.
Trüf mantarı bir kap içinde, buzdolabında muhafaza edilmeli ve suyla temas etmemesine dikkat edilmelidir, çünkü üzerine değen su, trüf mantarının çürümesine neden olur.
En bilinen türleri olarak Tuber magnatum (Beyaz trüf), Tuber melanosporum (Siyah kış trüfü) ve Tuber aestivum (Yaz trüfü) söylenebilir. Bunlardan beyaz trüf en nadir bulunan ve en lezzetli trüf çeşididir. Çiğ yenmesi tavsiye edilir. Renk ve şekil olarak patatese benzer. Çoğunlukla İtalyanın kuzeybatısındaki Piedmont bölgesinde yetişir.
Daha az bilinen Oregon beyazının da iki çeşidi bulunmaktadır (Tuber oregonese ve Tuber gibbosum). Her ikisi de olgunlaşmadan önce beyaz renkte olup, olgunlaşma döneminde turuncu-kahverengi ve solgun yeşilimsi kahverengi hale dönüşürler.
Trüf mantarı nerede yetişir ? : Trüf mantarı genelde meşe ve kestane ağaçlarının köklerine bağlı olarak, yerin 5-50 cm altında yetişir. Bu nedenle bulunması son derece zordur. Trüf mantarı bulmak için özel yetiştirilmiş köpeklerden faydalanılır.
Türkiye’de trüf mantarı çok yaygın olmasa da ekolojik olarak trüf mantarının yetişebileceği uygun bölgeler vardır. Güneydoğu Anadolu bölgesinde zaman zaman toplanır. Ayrıca Trakya ve Kuzey Anadolu bölgesi de trüf mantarının yetişmesi için uygun iklim ve bitki örtüsüne sahiptir.
Toplanması için belirli bir mevsim yoktur zira 70’ten fazla çeşidi olan trüf mantarının her çeşidi farklı iklim ve bitki şartlarında yetişir.
Tüm doğal mantarlar gibi trüf mantarı da doğada bulunan zehirli mantarlar ile karıştırılabilir. Bu sayfadaki fotoğraf ve açıklamalar, örnek ve bilgilendirme amaçlıdır.
UYARI : Bu sayfadaki bilgileri kullanarak mantar toplamayın. Zehirli ve yenilebilen mantarları birbirinden ayırt etmek bazen çok zor olduğundan yabani mantarlar sadece uzmanlar tarafından toplanmalıdır.
Örümcek zehri
Karadul örümceğine ait 1 gram zehir, 62 bin 500 euroÖrümcek türleri arasında en çok korkulan ve en güçlü zehre sahip olan karadul örümceği ismini acımasız bir özelliğinden almıştır. Çiftleşme sırasında veya çiftleştikten sonra erkek örümceği acımasızca yiyen karadul örümceği ''karadul'' adını almıştır.
Sıklıkla görüldüğü ve genel yaşam alanı Amerika'dır.
Karadul örümcekleri erkeklere göre oldukça büyüktür. Ortalama bir karadul bir erkek karadul 'a göre 3 kat daha fazla büyüktür. Neredeyse her gün beslenen dişi karadul örümceğinin yanı sıra erkeği hayatı boyunca beslenmez ve kısa bir ömür sürer.
Avlanma şekli bakımından diğer örümcek türleri ile benzerlik gösterir. Diğer örümcek türleri gibi ağını avını yakalamak için kullanır ve hareketsiz hale gelen avını sindire sindire yer.
Dişi örümceğin zehri oldukça kuvvetlidir. Hatta örümcek türleri arasında en kuvvetli zehir karadul örümceğin de bulunur. Bünyesi zayıf bir insanı kolayca öldürebilecek asit içerikli bir zehir salgılar. Genel olarak insan ölümleri çok sık görülmese de zehrinin tehlike oranını karadul örümceğini gözlemleyen birçok kişi farkındadır.
Karadul örümceklerinin zehri direk sinir sistemine ve kas sistemine etki eder. İlk olarak felç etkisi gösterir ve kasları eriterek etkisiz hale getirir. Tedavisi hızlı bir şekilde yapılmazsa ölümle sonuçlanabilir.
Zehir, örümcekten sağılarak laboratuvarlara satılıyor ve ilaç üretiminde kullanılıyor.
Safran
Safran 1 gramı: 11.13 dolarSafran (Crocus sativus), süsengiller (Iridaceae) familyasından, sonbaharda çiçek açan, 20–30 cm boyunda, çiğdem (Crocus) cinsinden soğanlı bir kültür bitkisi ve bu bitkiden elde edilen baharat. Bitkinin yaprakları şeritimsi, mor çiçekleri üç tepeciklidir. Çiçeği ve tepecikleri bitkiye bağlayan yaprak sapı da dâhil olmak üzere erkek organları kurutularak özellikle gıda boyası ve tat verici olarak kullanılan safran bitkisi daha çok İspanya, Fransa, İtalya ve İran'da yetiştirilir. Türkiye’de ise safran Safranbolu’da üretilmektedir. Ağırlığına göre dünyanın en pahalı baharatı, (bir gramı 5 ile 6 € arası), olan safranın anavatanı Güneybatı Asya’dır. Yetiştiriciliğine ilk olarak Yunanistan civarında başlanmıştır. Yarım kilogram safran 80.000 çiçekten çıkarılabilir. Kendi ağırlığının 100.000 katı suyu sarı renge boyar.
Safran baharatının keskin bir tadı ve iyodoform ya da saman benzeri bir kokusu vardır. Bunların sebebi, bileşiminde bulunan pikrokrosin ve safranal kimyasallarıdır. Aynı zamanda içine konduğu yemeklere altın gibi sarı bir renk katan, krosin adı verilen karotenoit bir boya maddesi de içerir. Bu özellikler safranı dünya çapında çok aranan bir baharat yapar. Ayrıca tıpta da kullanılır.
Safran kelimesi Arapça sarı renk anlamına gelen asfar (أَصْفَر) kelimesinden türetilen ve Arapçada safran baharatı anlamına gelen za’feran (زَعْفَرَان ) kelimesinden kaynaklanarak Latinceye safranum, İtalyancaya zafferano ve İspanyolcaya azafrán olarak geçmiştir. Daha sonra Fransızcaya safran ve oradan da İngilizceye saffron olarak aktarılmıştır.
Safron çeşitli ağrılardan depresyon tedavisine kadar çeşitli kullanım alanları olan çiçekli bir bitki. Ancak yalnıca bir gramı bile 11 dolar eden bu değerli çiçek dünya çapında oldukça değerli sayılıyor.
Kültür bitkisi olan safran C. sativus, sonbaharda çiçek açan ve doğal yaşamda kendi başına bulunmayan çok yıllık bir bitkidir. Sonbaharda çiçek açan Doğu Akdeniz’in Crocus cartwrightianus bitkisinin kısır bir triploid mutantıdır . Botanik araştırmalarına göre C. cartwrightianus bir zamanlar düşünüldüğü gibi Orta Asya’da değil Girit’te ortaya çıkmıştır. Safran bitkisinin ortaya çıkışı ise C. cartwrightianus yetiştiricilerinin daha uzun tepeciklere sahip bitkiler üretebilmek için yaptıkları aşırı yapay seleksiyonun sonucudur. Kısır olmaları nedeniyle safran bitkisinin mor çiçekleri üretken tohum üretemez ve çiçeğin üremesi insana bağlı kalır. Toprak altında kalan ve üreme organı görevini yapan soğanlar toprak kazılarak çıkarılmalı, bölünerek ayrılmalı ve tekrar dikilmelidir. Bir soğan yalnızca bir mevsim yaşar, bölünerek yaklaşık on tane soğancık üretir ve bu soğancıklardan yeni bitkiler ürer. Soğanlar yaklaşık 4,5 cm çapında küçük kahverengi yuvarlardır ve sık bir hasır şeklinde paralel lifçiklerden oluşmuştur.
Bir yaz uykusu geçirdikten sonra topraktan, 40 cm’ye kadar büyüyen, beş ila on bir adet dar ve dik yeşil yaprak çıkar. Sonbaharda mor tomurcuklar kendini gösterir. Ekim ayında, diğer tüm çiçekli bitkiler tohumlarını bıraktıktan sonra açık pastel leylak renginden daha koyu bir mor renkte parlak renkli çiçekleri açar . Çiçek verdiği sırada bitki 30 cm’den daha yüksek değildir. Her çiçeğin ucunda üçlü bir erkeklik organı bulunur ve bunların ucunda 25–30 mm’lik koyu kırmızı tepecikler yer alır.
Yetiştiricilik : Safran bitkisi, Akdeniz maki ve Kuzey Amerika chaparral bitki örtüsünün yaşadığına benzer, sıcak ve kuru yaz rüzgârlarının estiği yarı kurak iklimlerde büyür. Bitki, soğuk kışları da atlatabilir ve kısa süre kar altında kalabildiği gibi -10 °C’lik donlara da karşı koyabilir. Ancak Keşmir gibi yıllık 1000–1500 mm yağış alan nemli iklimlerde yetiştirilmediği takdirde sulama gerektirir. Yıllık 500 mm yağış alan Yunanistan’da ve yıllık 400 mm yağış alan İspanya’da sulama olmadan yetiştirilemez. Yağmurların zamanlaması da önemlidir. Cömert bahar yağmurlarının ardından gelen kuru yazlar optimal koşullardır. Buna ek olarak çiçek açmasından hemen önce yağan yağmurlar safran mahsulünü artırır. Ancak tam çiçek açarken soğuk ve yağmurlu hava ile karşılaşınca hastalığın artması nedeniyle üretim miktarı düşer. Sürekli nem ve sıcak hava ile tavşan, sıçan ve kuşların toprağı kazmaları da üretimi kötü yönde etkiler. İplikkurdu ve yaprak mantarı gibi parazitlerle soğan çürümesi de önemli tehditlerdir.
Safran bitkisi güçlü ve doğrudan güneş ışığını ne kadar severse, gölgede kalmaktan da o kadar hoşlanmaz. Dolayısıyla gün ışığı alan yamaçlar (kuzey yarıkürede güneye doğru) safran bitkisi dikimi için en elverişli yerlerdir ve buralarda çiçek en yüksek oranda güneş ışığı alır. Kuzey yarıkürede soğan dikimi 7–15 cm derinlikte olmak üzere haziran ayında yapılır. Soğanların dikildiği derinlik, aralık ve iklim, ürün miktarını etkileyen kritik faktörlerdir. Daha derine dikilen ana soğanlar daha yüksek kaliteli safran üretir ama daha az çiçek tomurcuğuna ve yavru soğancığa sahip olurlar. Bu bilgilerin ışığı altında İtalyan yetiştiriciler soğanları 2–3 cm aralıklarla 15 cm derinliğe diktiklerinde mahsul kalitesini artırırlar. 8–10 cm derinliğe diktiklerinde ise hem çiçek hem de soğancık üretimini optimize ederler. Yunan, Faslı ve İspanyol yetiştiriciler ise kendi iklim koşullarına uygun olan farklı derinlik ve aralıklarda dikim yapmaktadır.
Safran bitkisinin en severek yetiştiği toprak gevrek, gevşek, düşük yoğunluklu, iyi sulanmış ve iyi akaçlanmış, yüksek organik içerikli killi ve kalker topraktır. Kabartılmış dikim yatakları iyi akaçlamayı sağlamak için kullanılan geleneksel bir yöntemdir. Toprağın organik içeriğini sağlamak için tarihsel olarak hektar başına 20–30 ton gübre kullanılır. Ama daha sonraları, daha fazla gübre kullanmadan soğanlar dikilmiştir. Yaz mevsimini uyuyarak geçiren soğan, sonbaharın başında dar yapraklarını yukarı gönderir ve tomurcuklanmaya başlar. Bitki ancak sonbahar ortasında çiçeklenmeye başlar. Çiçeklerin hasatı çok hızlı yapılmak durumundadır çünkü gün ağarırken açan çiçekler gün ilerledikçe solmaya başlar. Üstelik safran bitkisi bir ila iki haftalık çok kısa bir dönem içinde çiçeklenir. Yaklaşık olarak 150 çiçek 1 g kuru safran lifi verir. 12 g kuru safran ya da 72 g taze toplanmış safran elde etmek için 1 kg çiçek gerekir. Ortalama olarak taze toplanmış bir çiçek 0,03 g taze safran ya da 0,007 g kuru safran verir.
Kimya : Safran 150’den fazla uçucu ve aroma taşıyan bileşik içerir. Bunların çoğu aralarında zeaksantin, likopen, ve değişik α- ve β-karoten de bulunan karotenoidlerdir. Ancak safran altın sarısı – turuncu rengini α-krosine borçludur. Bu krosin trans-krosetin di-(β-D-gentiyobiyosil) ester dir (sistematik (IUPAC) adı: 8,8-diapo-8,8-karotenoik asit). Yani safranın aromasının altında yatan karotenoit krosetinin digentiobioz esteridir. Krosinler, krosetin esterlerin monoglikosil ya da diglikosil olmayan hidrofilik bir grup karotenoiddir. Aynı zamanda krosetin bir konjüge polien dikarboksilik asittir, ayrıca hidrofobiktir ve dolayısıyla da yağda çözünür. Krosetin iki suda çözünen gentiobioz ile (yani şekerlerle) birleşince ortaya çıkan ürün de suda çözünür. Ortaya çıkan α-krosin kuru safranın kütlesinin %10’undan fazlasını oluşturan bir karotenoit pigmentidir. Bu iki esterleşmiş gentiobioz, suda çözünür hâle gelmiş olan α-krosini, pirinç pilavı gibi su bazlı yemekleri renklendirmek için ideal bir ürün yapar.
Safranın tadı keskin glükozit pikrokrosinden gelir. Pikrokrosin (Kimyasal formülü: C16H26O7; sistematik adı: 4-(β-D-glükopiranosiloksi)-2,6,6- trimetilsikloheks-1-en-1-karboksaldehit) safranal (sistematik adı: 2,6,6-trimetilsikloheksa-1,3-dien-1- karboksaldehit) diye bilinen bir aldehit alt elemanı ile bir karbonhidratın bileşiminden oluşur. Böcek öldürücü özellikleri olan pikrokrosin kuru safranın %4’ü kadarını oluşturur. Özellikle pikrokrosin, zeaksantin karotenoit (oksidatif parçalanma ile) kısalmış bir seklidir ve terpen aldehit olan safranalın bir glükozit türevidir. Kızıl renkli zeaksantin insan gözünde retinada doğal olarak bulunan birkaç karotenoitten birisidir.
Safran hasattan sonra kurutulduğunda sıcaklıkla birleşen enzim etkisi sonucunda pikrokrosin D-glükoz ve serbest bir safranal molekülüne ayrışır. Uçucu bir yağ olan safranal, safranın ayırt edici aromasının önemli bileşenlerinden biridir. Safranal pikrokrosinden daha az keskindir ve bazı örneklemelerde kuru safranın uçucu bölümünün %70’ini oluşturur. Safranın aromasının altında yatan ikinci bir bileşen, kokusu "safran ya da kurumuş saman gibi" tarif edilmiş olan, 2-hidroksi-4,4,6-trimetil-2,5-sikloheksadien-1-on’dur. Safranaldan daha az bir oranda bulunmasına rağmen bu bileşen kimyacılar tarafından safranın kokusuna en önemli katkıyı sağlayan bileşen olarak tanımlanmıştır. Kuru safran pH değişmelerine karşı çok hassastır ve ışık ile oksitlendirici etmenlerin etkisiyle kimyasal olarak hemen parçalanır. Atmosferdeki oksijen ile temasını minimize etmek için hava geçirmez kaplarda saklanmalıdır. Safran ısıya karşı biraz daha dayanıklıdır.
Tarihçe : Safran yetiştiriciliğinin tarihi 3.000 yıl öncesine kadar uzanır Kültür bitkisi olan safranın doğada bulunan öncülü Crocus cartwrightianustur. İnsan yetiştiriciler, aşırı uzun tepeciğe sahip olan örnekleri seçerek yetiştirdi. Bunun sonucunda C. cartwrightianusun kısır bir mutant formu olarak C. sativus Bronz Çağı’nda Girit’te ortaya çıktı. Uzmanlara göre safrandan bahseden ilk doküman MÖ 7. yüzyıldan kalma Asurlular döneminde Asurbanipal tarafından toplatılan bir botanik kaynakçasıdır. Bundan sonra 4.000 yıl boyunca safranın 90 kadar hastalığın tedavisinde kullanıldığına dair dokümantasyon ortaya çıkarılmıştır. O tarihlerden beri Akdeniz bölgesinde hem baharat hem de ilaç olarak kullanılan safran yavaş yavaş Avrasya’nın diğer bölgeleriyle Kuzey Afrika ve Kuzey Amerika’ya kadar yayılmıştır. Son yıllarda safran üreticiliği Okyanusya kıtasına da uzanmıştır.
Akdeniz : Minos uygarlığı zamanında MÖ 1500–1600 yılları arasında safranın tedavi amaçlı ilaç olarak kullanıldığını gösteren saray freskleri bulunmuştur. Sonraları Yunan efsanelerinde Kilikya’ya yapılan deniz yolculuklarından bahsedilir. Maceraperestlerin oraya dünyanın en değerli safranı olduğuna inandıkları safranı bulma ümidiyle gittiği aktarılır. Başka bir efsanede Crocus ve Smilax’tan bahseder. Büyülenen Crocus ilk safran bitkisine dönüşür. Antik Akdeniz ulusları; Mısırlı parfümcüler, Gazalı doktorlar, Rodoslu kasabalılar ve Yunan hetaerae adı verilen saray kadınları parfümlerde, merhemlerde potpurilerde, maskaralarda, kutsal sunaklarda ve tıbbi tedavilerde safran kullanmıştır.
Helenistik Mısır döneminin sonlarında Kleopatra'nın, sevişmelerinin daha zevkli geçmesi için banyosunda safran kullandığı bilinir. Mısırlı sağlıkçılar her türlü gastroentestinal tedavi için safranı kullanırdı. Sidon ve Tyre gibi şehirlerde de safran dokumaların boyanmasında kullanılmıştır. Romalılar safranı o kadar çok seviyordu ki Romalılar Güney Galya kolonilerinde yanlarında getirdikleri safranı Roma yıkılıncaya kadar oldukça yaygın bir biçimde yetiştirmişlerdir. Farklı teoriler safranın Fransa’ya tekrar dönmesini 8. yüzyılda Endülüslülere ya da 14. yüzyılda Avignon papalığına bağlar.
Asya : Irak’ta 50.000 yıllık tarih öncesi hayvan tasvirlerinde safran bazlı pigmentlere rastlanmıştır. Sonraları Sümerler doğada büyüyen safranı tedavi ve sihirli iksir yapmak için kullandı. Safran, MÖ 2. binyılda Minos saray kültüründen çok daha önce bir ticaret malı olarak kullanılıyordu. Yahudi dilinde Süleyman’ın Şarkısı’nda da safrandan saygıyla söz edilir. ] Antik Persler MÖ 10. yüzyılda Derbena, İsfahan ve Horasan şehirlerinde Fars safranı (Crocus sativus 'Hausknechtii') yetiştirdi. Bu yerlerde safran lifleri tanrılara sunulan dokumalarda, boya, parfüm ve ilaçlarda kullanılmıştır. Safran lifleri yataklara serpilmiş ve melankoli krizlerini iyileştirmek için sıcak çaylarla karıştırılmıştır. Perslerin safranı uyuşturucu maddelerle birlikte ve afrodizyak olarak kullandığı da sanılmaktadır. Asya seferleri sırasında Büyük İskender safranı, içecek ve yiyeceklerinde kullandığı gibi savaş yaralarını tedavi amacıyla banyosunda da kullanmıştır. İskender'i taklit eden askerleri safran ile banyo alma alışkanlığını Yunanistan’a getirmişlerdir.
Safranın Güney Asya’ya gelişiyle ilgili birbiriyle çelişen teoriler bulunur. Geleneksel Keşmir ve Çin söylencelerine göre safran 900 ila 2500 yıl önce bir zamanda buralara ulaşmıştır. Antik Pers kayıtlarını inceleyen tarihçiler bu tarihin MÖ 500 yılından önce olduğunu bulmuşlardır. Bu ya Perslerin park ve bahçelerde safran soğanlarını dikmeleriyle ya da Perslerin Keşmir’i işgal edip orada koloni kurmasıyla olmuştur. Fenikeliler Keşmir safranını boya olarak ve melankoli tedavisi için pazarlamışlardı. Daha sonra tüm Güney Asya’da yemeklerde ve boya olarak safran kullanımı yaygınlaşmıştır. Örneğin Hindistan’da Budist keşişler Buddha Siddhartha Gautama'nın ölümünden sonra safran renkli giysiler giymeye başlamışlardır.
7. yüzyıldan Ermeni yazar Şiraklı Ananya Çin’i şöyle tanımlamıştır:
| “ | Orada o kadar çok safran vardır ki eğer birisi bembeyaz giyinmiş şekilde, beyaz bir atın üstünde ve beyaz bir şahin ile ava çıksa geriye döndüğünde hepsi sapsarı olurdu. | ,, |
Gerçekten de eski Çin tıp kitaplarında safrandan söz edilir. MÖ 200 ile 300 yıllarından kalma ve efsanevi Yan ("Ateş") İmparatoru (炎帝) Şennong’un hazırladığı düşünülen kırk ciltlik Shennong Bencaojing (神農本草經 – "Şennong's Büyük Şifalı Bitkiler Kitabı " ya da Pen Ts'ao veya Pun Tsao diye de bilinir.) adlı ilaçlarla ilgili eserde farklı rahatsızlıklar için bitkilerden yapılan 252 tedavi şeklinden söz edilir. Ancak 3. yüzyılda Çinliler safranın Keşmir'den geldiğinden söz ediyordu. Çinli bir tıp uzmanı Wan Zhen, "Safran, Buda’ya sunulmak üzere Keşmir’de yetiştirilir." diye yazmıştı. Wan kendi döneminde safranın nasıl kullanıldığını da şöyle anlatmıştır: "Safran çiçeği birkaç gün sonra solar sonra da safran elde edilir. Sarı rengi nedeniyle değerlidir. Şaraba koku vermek için kullanılır.
Rodyum
Rodyum 1 gramı: 58 dolarRodyum, periyodik tabloda Rh sembolüyle gösterilen atom numarası 45 olan elementtir. Az bulunan beyaz-gümüş renkte ve platin grubuna aittir. Alaşımlarda platinle birlikte katalizör olarak kullanılır. Kıymetli metaller arasında dünyada 3. en pahalı olanıdır.
Karakteristik özellikleri : Katı, gümüşümsü beyaz, dayanıklı ve yansıma oranı yüksektir. Yüksek ısıya maruz kaldığında bile oksitlenmez. Platinden daha yüksek bir erime noktasına sahip olmasına karşın yoğunluğu daha düşüktür. Nitrik asit tarafından çözülemez. Hidroklorik asit ve nitrik asit karışımı tarafından çok az miktarda çözülebilir. Pudra hâlindeki rodyumun çözülebilmesi sadece sülfürik asitle mümkündür.
Kullanılışı :Bu elementin başlıca kullanımı otomobil sektöründe katalizör dönüştürücüdür: motordan çıkan zehirli gazları daha az zehirli gazlara dönüştürür. Diğer kullanım alanları ise: platin ve paladyumun katılaşması ve korozyona karşı dirençli olmaları içindir.
- Düşük elektrik direnci, düşük ve sabit kontak direnci ve yüksek korozyon direnci sebebiyle elektrik kontaklarında kullanılır.
- Elektrolizle kaplanmış ya da buharlaşmayla elde edilen levha hâlindeki rodyum son derece sert olduğundan optik aletlerde kullanılır.
- Bu metalin mücevher yapımında dekor amacıyla kullanımı da mevcuttur. Beyaz altına ve platine yansıtıcı bir yüzey kazandırır. Bu da kuyumculukta "rodyum yansıması" olarak bilinir. Saf rodyum takılar, bu metalin yüksek fiyatı, yüksek erime noktası ve şekil verilebilmesi çok zor olması sebebiyle çok nadirdir.
- Endüstriyel oluşumlarda sıkça kullanılan bir katalizördür. Çoğunlukla arabaların katalitik sistemlerinde ve asetik asit üretmek üzere metil alkolün katalitik karbonlaşması için Monsanto süreci için kullanılır.
- Ürettiği karakteristik X-ray ışınları sebebiyle mamografi sistemlerinde kullanılır.
- Faber-Castell, Pelikan, Mont-Blanc, Monte Grappa, Pensan, Caran D'Ache gibi kaliteli kalem üreticileri tarafından çok dirençli bir metal olması sebebiyle de kullanımı mevcuttur.
Önlemler : Rodyum yüksek derecede zehirli ve kansorejen bir yapıya sahiptir. İnsanın karşısına sıkça çıkan bir madde değildir fakat insan hayatı için çok tehlikeli olduğu dikkate alınmalıdır. 12.6 mg/kg rodyum klorür (RhCl13) bir insanı öldürür.
Platinyum
Platinyum 1 gramı: 58 dolarPlatin, Periyodik cetvelde Pt simgesi ile gösterilen kimyasal bir element olup atom numarası 78'dir. Ağır, dövülebilir, sünek, grimsi beyaz renkli, geçiş metalleri grubunda, kıymetli metallerdendir.Altından sonraki en kıymetli metaldir . Korozyona dayanıklı olup bazı bakır ve nikel cevherlerinde bulunur. Kuyumculukta, laboratuvar cihazlarında, elektrik kontaktlarında, diş hekimliğinde ve otomobil egzoz kontrol cihazlarında kullanılır.
Simyacıların platin için kullandıkları simge, altın ve gümüşün simgelerinin bir araya getirilmiş şeklidir.
Önemli özellikleri : Platin saf hâldeyken gümüşümsü beyaz renklidir. Korozyona dayanıklıdır. Platin grubu metallerin altı üyesinin de (rutenyum, rodyum, paladyum, osmiyum, iridyum, ve platin) katalitik özellikleri çok üstündür. Bu nedenle platin, otomobillerin egzoz sistemlerindeki katalitik dönüştürücülerde ve bujilerin uçlarında kullanılır.
Platin, yüksek aşınma ve kararma direncinden ötürü ideal bir hassas kuyumculuk metalidir. Platin altından daha kıymetlidir. Platin fiyatları, piyasadaki arz-talep dengesine göre değişmekle birlikte normalde altının iki mislidir. Dünya'da bilinen en değerli 2. maden olduğu bilinmektedir. 18. yüzyılda platinin nadir bulunur oluşu, Kral XV. Louis'nin onu, "krallara layık tek metal" olarak tanımlamasına neden olmuştur.
Göze çarpan diğer özellikleri arasında; kimyasallara karşı direnç, çok üstün yüksek sıcaklık özellikleri, ve kararlı elektriksel özellikler sayılabilir. Platin havada hiçbir sıcaklıkta korozyona uğramaz, ancak siyanür, halojenler, kükürt, ve alkaliler tarafından korozyona uğratılır. Hidroklorik asit (HCl) ve nitrik asit (HNO3) içerisinde çözünmez fakat kral suyu (aqua regia) olarak bilinen karışımda kloro-platinik asit oluşturarak çözünür. Bilinen oksidasyon kademeleri +2, +3, ve +4'tür.
Kullanım alanları : Laboratuvar kaplarının, bozunmaya dayanıklı gereçlerin, tellerin ve ısıluçların yapımında, kuyumculukta, diş hekimliğinde ve elektrik kontaklarında kullanılır. Platin-kobalt alaşımları güçlü manyetik özellik gösterir. Platin rezistans telleri, çok yüksek sıcaklıklarda çalışan elektrikli fırınların yapımında kullanılır. Arabalarda hava kirliliğini önleyici donanımların yapımında, füzelerin uç konilerinin ve jet motorlarının ağızlıklarının kaplamasında, büyük gemilerin, denizaltı boru hatlarının ve çelik desteklerin katodik koruma sistemlerinde de platinden yararlanılır. Sülfürik asit eldesinde ve petrol ürünlerinin işlenmesinde katalizör olarak platin kullanılmaktadır. Platin dirençli termometreler, elektrolizde kullanılan elektrotlarda da yer alıyor.
Platin bileşiklerininse daha da yaygın kullanım alanları bulunur. Örneğin sisplatin, karboplatin ve okzaliplatinin DNA yapısı arasına girme özelliklerinden dolayı kanser tedavisinde kemoterapi sırasında kullanılabiliyor. Hekza kloroplatin asitse fotoğrafçılık, aynalar, mürekkep, porselen renklendirmesi, çinkonun aşındırılmasında kullanılmaktadır.
Tarihçe : Doğal hâlde bulunan platin ve platin alaşımlarının varlığı uzun zamandan beri bilinmektedir. Platin, Kristof Kolomb öncesi Amerikan yerlileri tarafından kullanılmışsa da Avrupalıların bu metalden ilk defa söz etmeleri 1557 yılına rastlar: bir İtalyan Hümanisti olan Julius Sezar Skaliger (1484-1558), Panama ve Meksika arasındaki bir Orta Amerika madeninde bulunan bu gizemli metalden bahsederken onu, "şimdiye dek bilinen hiçbir İspanyol sanatıyla ergitilemeyen" olarak tanımlamıştır.
İspanyollar metali ilk olarak Kolombiya'da bulduklarında ona "platina" veya "küçük gümüş" adını vermişlerdir. Platini gümüş cevherleri içerisinde istenmeyen bir empürite olarak görmüşler ve çoğunlukla da atmışlardır.
Platin ilk olarak Antonio de Ulloa ve Don Jorge Juan y Santacilia adlı iki astronom tarafından keşfedilmiştir. Her ikisi de İspanya Kralı V. Felipe tarafından 1735-1745 arasında Peru'daki bir keşif gezisi için görevlendirilmişti. Ulloa, platina"yı, New Granada'da (Kolombiya) altınla birlikte bulunan ve işlenemeyen metal olarak tanımladı. Ulloa'nın gemisine dönüş yolculuğunda İngilizler tarafından el konuldu ve İngiltere'ye götürüldü. Kendisine iyi davranıldı, hatta Royal Society'ye üye bile yapıldı. Ancak bu bilinmeyen metalden bahsetmesi, hakkında yayın yapması 1748'e kadar yasaklandı. Oysa Charles Wood bu gelişmelerden bağımsız olarak 1741'de metali ayrıştırmıştı.
Uzun yıllar boyunca uzunluk ölçüsü birimi "metre"nin tanımı, Sevr'deki (Fransa) Bureau International des Poids et Mesures'de bulunan platin-iridyum alaşımından yapılmış bir çubuk üzerindeki iki işaret arasındaki mesafe olarak tanımlanmıştır. Yine aynı şekilde platin-iridyum alaşımından yapılmış bir silindir de kilogram standardı olarak aynı yerde bulunmaktadır. Platin, standard hidrojen elektrodunun tanımında da kullanılmaktadır.
Platin genellikle saf ya da iridyum ile alaşım halinde bulunur. Platin arsenik (sperilit minerali (PtAs2)), Kanada'daki Sudbury cevher yataklarında nikel cevherleriyle bir arada bulunan ana platin kaynağıdır. Daha nadir bulunan sülfürlü minerali kuperit ((Pt,Pd,Ni)S) ise platini, paladyum ve nikel ile birlikte içerir. Kuperit'e genellikle Transvaal'de (Güney Afrika) rastlanır.
Platin daha çok diğer platin grubu metallerle (PGM) birlikte ve Witwatersrand (Güney Afrika), Kolombiya, Ontario, Ural Dağları, ve bazı batı Amerika eyaletlerindeki alüvyal plasiyer cevher yataklarında bulunur.
Platin ticari anlamda Sudbury cevher yataklarındaki nikel cevherlerinin işlenmesi sırasında yan ürün olarak elde edilir. Bu cevherlerde platinin yalnızca 0,5 ppm (1 ppm = milyonda bir) mertebesinde bulunması bile platinin ne kadar kıymetli ve işlenmeye değer olduğunun bir göstergesidir.
İzotopları : Platinin beş adet kararlı izotopu ve bir de yarılanma ömrü 6 milyar yıl olan radyo-izotopu vardır: Pt-190. Platinin başka radyo-izotopları da vardır ve bunlardan en kararsızı yarılanma ömrü 50 yıl olan Pt-193'tür.
Önlemler : Platin reaktif bir metal olmadığından herhangi bir sağlık problemi yaratmaz. Bazı platin kompleksleri (cis-platin), anti-tümör aktivitelerinden dolayı kemoterapi alanında kullanılmakta iseler de böbreklerde geri dönüşümü olmayan tahribata yol açarlar.
Metamfetamin
Metamfetamin 1 gramı: 100 dolarMetamfetamin (kristal meth); uyarıcı ve halüsinasyon özelliği olan sentetik bir maddedir. Birçok uyarıcı gibi, 6-24 saat süren güçlü bir öfori; dolayısıyla bağımlılık yapma yeteneğine sahiptir. Yapı olarak amfetamine yakın psikoaktif bir maddedir.
IUPAC ismi (S)-N-metil-1-fenil-propan-2-amin olan methamfetamin, jenerik ismi Desoxyn® olarak 5/10 mg tabletler halinde ABD piyasasında bulunmaktadır. Ancak madde suistimal edilmek üzere kaçak üretimi ile tanınmıştır. Efedrin ya da Psödoefedrin molekülü hidrojenize edilerek kolayca elde edilebildiğinden hemen her yerde üretilebilmektedir. "Meth lab" de denilen bu yerler, üretimi sırasında çıkan fosfattan ötürü kırmızı bir renge boyanır ve kedi idrarı kokusuna sahiptir.
Bulunuşu : 1887 yılında metamfetamin sentezlenmesinden kısa bir süre sonra, metamfetamin efedrin maddesinden ilk kez 1893'te kimyager Nagai Nagayoshi tarafından sentezlendi. "Metamfetamin" terimi bu yeni karışımın kimyasal yapısından türedi:methyl alpha-methylphenethylamine. 1919 yılında, kristalize metamfetamin farmakolog Akira Ogata tarafından efedrinin redoks yöntemiyle kırmızı fosfor ve iyot kullanılarak sentezlendi.
Etkileri : Uyanıklık, motivasyon ve kısa dönem beyin aktivitesini artıran madde yüksek dozlarda öforiye neden olmaktadır. Madde alındığında tansiyon ve vücut sıcaklığı yükselir, göz bebekleri genişler. İshal, bulantı, kusma görülebilir .
Beyin kimyasını bozup depresyona yol açtığı bilinmektedir. Bağımlılarında kalıcı anhedoni oluşmaktadır. Eroin'den daha kuvetli bağımlılık yaptığı ileri sürülmüştür.
Devamlı kullanıcılarında meth ağzı denen diş çürükleri gözükür, bağışıklık sistemi baskılanır. Bu kişilerde stafilokok enfeksiyonları sıktır. Kilo kaybı ve kısa dönem libido artışı, ardından erektil disfonksiyon da bilinen etkilerindendir.
Kuvvetli sistemik reaksiyon ile ölüm görülebilir.
Gergadan boynuzu
Gergadan boynuzu: 1 gramı: 110 dolarGergedan, tropikal bölgelerde yaşayan iri yapılı, boynuzlu, toynaklı, memeli ve otçul bir hayvandır. Tarih öncesi çağlardan günümüze kadar soyunu devam ettirebilen, yalnızca beş gergedan türü kalmıştır. Bunlardan iki türü Afrika’da, diğer üç türü ise Hindistan, Malezya ve Endonezya’da yaşar. Yalnızca Afrika’da ve Asya’da yaşayan gergedanların, tarih öncesi çağlarda Avrupa’da yaşayan türlere ait fosiller de bulunmuştur.
Gergedanın Özellikleri: Gergedanlar devasa cüsseleriyle, fillerden sonra dünyanın en büyük kara hayvanıdır. Afrika’da yaşayan türlerinin ağırlıkları 1000 – 3600 kilo, yerden yüksekliği 1-2 metre, uzunluğu 4 metre civarındadır. Şişman gövdeye, kısa bacaklara, boynuzlara ve çok kalın, tüysüz, zırhı andıran deriye sahiptir. Boynuzlarıyla dikkat çeken gergedanların boynuz uzunluğu 40 ila 160 cm arasında değişir. Kulakları çok iyi işitir ama Gözleri çok iyi göremez. 20 metre kadar uzaktaki bir insanı zor ayırt edebilir. Ancak burnu kokulara karşı çok hassastır, kilometrelerce uzaktan tehlikeli bir canlının kokusunu alabilir. Tehlike anında saatte 40 kilometre hızlı koşabilir.
Gergedanların Yaşamı ve Beslenmesi: Gergedanlar sıcak ve kurak yerlerdeki çalılıklı geniş araziler, ormana yakın yerler veya yarı çöl yerlerde yaşamayı tercih ederler. Genellikle tek başına, bazen de küçük gruplar halinde yaşarlar. Her gergedanın kendine ait bölgesi vardır. Bölgelerini idrar ve dışkılarıyla işaretleyerek belirlerler. Bölgesi içinde genellikle kendi türleriyle yaşamayı sevmeyen gergedanlar, bölgesindeki diğer hayvan türleriyle iyi geçinir. Kalın derilerinde ter bezleri olmadığından, sık sık çamur banyosu yaparak serinleme ihtiyacı duyarlar. Çok iri ve kalın derili olmasına rağmen fil, aslan ve timsahların saldırıları sonucunda ölebilirler. Derisine yapışarak beslenen parazitlere karşı hassas olan gergedanlar, parazitlerden kurtulmak için kuşların sırtındaki parazitlerle beslenmesine izin verir.
Su kenarlarındaki otları, dikenli dikensiz çalıların taze sürgünlerini ve ağaçların yapraklarını yiyerek beslenirler. Ayrıca tuzu çok seven gergedan, sık sık burnuyla toprak sürerek tuz ihtiyacını karşılar. Gergedanların gebelik süresi, çiftleşmeden sonra 15-17 ay sürer. Erkek gergedan çiftleşme sonrası dişiyi terk eder. Dünyaya gelen yavru gergedanın ağırlığı 25-40 kilo civarındadır. Doğumdan 4 saat kadar sonra ayağa kalkarak gezinebilir ve meme emebilir. Üç buçuk yıl kadar annesiyle birlikte kalan gergedan yetişkinliğe erişerek annesini terk eder.
Gergedanların Nesli Tükenme Tehlikesiyle Karşı Karşıya: Avcılık ve yaşam alanlarının yok edilmesi sonucu sayıları giderek azalan gergedanların günümüzdeki sayısı 14.000 civarındadır. Bu sayı her geçen gün azalmaya devam etmektedir. Bölgede yaşayan yerliler için besin kaynağı olması, boynuzlarının süs eşyası olarak kullanıyor olması, turistlerin avlamak için büyük paralar dökmesi gergedanların sayısını hızla azaltmaktadır. Bunların yanı sıra yaşam alanlarının insan yapıları nedeniyle daraltılması veya yok edilmesi sonucu da gergedanların yok olmasını hızlandıran başka nedenlerdendir.
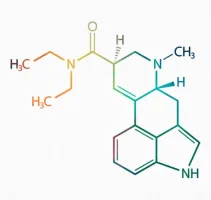
LSD
LSD 1 gramı: 3000 dolarLiserjik asit dietilamid, kısaca LSD ya da LSD-25, halk arasında asit olarak bilinir. İlk olarak 1936-1943 yılları arasında Albert Hoffman tarafından çavdar mahmuzundan sentezlenmiştir. Elde edilişi doğal, sentezi kimyasal, yarısentetik psikoaktif bir halüsinojendir.
Açık ve kapalı göz halüsinasyonları, değişen boyutsal zaman algısı, sinestezi etkisi, ruhani deneyimleri ve değişen düşünce süreci gibi psychedelic etkileri ve 1960'ların karşı kültüründeki yeri sebebiyle çok yaygın olarak bilinir. Ön beyinde 5-HT2A'nın doğrudan agonistidir. Tıp dünyasına göre bağımlılık yapmaz.
Dünya üzerinde en güçlü halüsinasyon gördüren madde olarak kabul edilmektedir. O kadar kuvvetli bir halüsinojendir ki yarattığı etkiler yıllar sonra bile ortaya çıkabilir. Halüsinasyon gördüren mantarlardan 100 kat, Meskalin'den 4000 kat daha güçlüdür
Tarihi : Albert Hofmann “Lysergic Acid Diethylamide"yi ilk defa 16 Kasım 1938 tarihinde tesadüfen sentezler. LSD; oksijen, morötesi ışık ve çözelti içinde klora karşı duyarlıdır ve ışık ve nemden uzak tutulursa uzun yıllar dayanabilir. Saf haliyle kokusuz, renksiz ve hafif acı bir tada sahiptir. LSD yaygın olarak emici kurutma kağıdı, jel tabletler, şeker küpü ve jelatin üzerinde ağız yoluyla alınır. Sıvı halinde damar içi ya da kas içi enjeksiyon ile de vücuda alınabilir. LSD çok etkilidir ve eşik dozu 20-30 mikrogramdır.
Albert Hoffman 1943 yılında, LSD’nin fizyolojik ve ruhsal etkilerini kendi üzerinde denemiş ve gözlemlerini "My Problem Child" adlı kitabına yazmıştır.
| “ | “19 Nisan 1943 Pazartesi günü saat 16.00’da Lysergic Acid Diethylamide Tartarat’ın %0,5 santimetre küp 0,25 miligram LSD içeren tatsız, yavan sıvıyı içtim. Saat 17.00’da baş dönmesi, endişe, kaygı ve tedirginlik başladı. Görmem bozuldu, düşüncelerim dağıldı, içimden gülme isteği geliyor, anlamlı konuşmak için büyük çaba sarf ediyorum, görme alanım sanki karşımda, eşyaların biçimi değişiyor, çevremi lunaparklarda olduğu gibi olağanüstü görüyorum. Bir süre sonra bunların hepsi geçti. Bütün bunları hatırlıyorum, baş dönmesi, görme bozuklukları, çevredeki eşyaların acayip gülünç ve kaba şekilleri... Renkli yüzler belirdi. Belirli bir tedirginlik vardı. Aralıklı olarak başımın, ayaklarımın ve bütün gövdemin ağırlığını duyuyorum, sanki madenle doldurulmuş gibi. Ayaklarda kramplar oluyor... Ellerde soğukluk ve sanki eriyip gidiyormuş gibi bir duygu var. Ağzımda maden tadında bir kuruluk, boğazda sıkışma, korku ve endişe, bilinçte bulanıklık... Bu arada içinde bulunduğun koşullarla gerçek arasında ayrım güçlüğünden doğan bir karışıklık. LSD’yi aldıktan altı saat sonra eski durumuma döndüm. Ancak ufak tefek görme bozuklukları kaldı. Her şey sallanıyor, eşyaların boyutları değişiyor. Sanki onların dalgalanan sudaki yansımasını izliyorum. Üstelik bütün eşyalar hoş olmayan görünümler kazanıyor. Renkler durmadan değişiyor. Yeşil ve mavi renkler üstünlük kazanıyor. Gözlerimi kapayınca fantastik, gerçekdışı biçimler görüyorum. Dikkati çeken bir nokta bütün seslerin gözüme yansıması ve türlü biçimlere dönüşmesi... Her ses, renk bir sanrıya (gerçekte olmayan olguları var gibi algılamak) dönüşüyor. Bunlar renk ve gölge olarak sürekli değişiyor. LSD’yi aldıktan sekiz, on saat sonra şiddetli bir uyku bastırdı. Ertesi gün biraz yorgun kalktım.”- Albert Hoffman 1943 | ,, |
1947 yılında Santos Laboratuvarları tarafından Delysid adıyla çeşitli psikiyatrik kullanım amaçlarıyla piyasaya sürülmüş bir ilaçtır. LSD hızlı bir şekilde umut veren bir tedavi ajanı olarak görüldü. CIA, 1950'lerde LSD'yi kimyasal silah ve akıl kontrolü için uygulanabilir olduğunu düşündü ve MKULTRA araştırma programı kapsamında genç askerler ve öğrenciler üzerinde denendi. Sonrasında 1960'larda Batı dünyasındaki genç neslin eğlence amacıyla ilacı kullanması politik tartışmalara yol açtı ve sonrasında ilaç yasaklandı. Halen kimi kurumlar LSD ve benzeri uyuşturucuların tıbbî ve ruhanî kullanımı için yapılacak araştırmalar için fon ayırmakta, teşvikte bulunmakta ve koordine etmektedir.
Etkileri : Halüsinojenler içerisinde en kuvvetli olandır. Algılama yapısını tamamen değiştirir ve kullanan kişiyi başka bir dünyaya (hayaller alemine) yollar. LSD etki sürecince, kişiyi gerçek dünyadan soyutlar ve kullanan kişinin ruh haline göre etki eder. Kişinin ruh hali duyduğu seslere, gördüğü görüntülere göre değişmekte, ses algısı dozuna göre değişmekle beraber görüntüleri çoklu, daha renkli ve farklı görmektedir. Çok mutlu olan biri LSD kullandığında cennete gittiğini görebilmektedir. Ama mutsuz olan kişileri iyi olmayan bir hayaller alemine götürür. LSD, kuşlarla beraber havada uçmak, uzay yolculuğu yapmak gibi, kişi için imkansız olanakları birebir gerçekmiş gibi yaşatır. LSD kullanan kişi, hayatında önemli bir yeri olmuş olan insanları da tekrar görebilir, onlarla iletişim kurabilir. LSD etkisinde kişi, genellikle etkilendiği konular üzerine hayaller görür. Çevresindeki nesneler de dahil, bu hayallere göre şekillenir. Her şey kişinin hayal kurmasına bağlıdır. LSD, bilinçaltında olan, eskiden yaşanmış olayları tekrar yaşamanıza/görmenize bile sebep olabilir. LSD etkisinde olan biri her türlü nesneyle iletişim kurabilir ve o nesnelerin onla diyaloğa girdiğini işitebilir.
Riskleri : Şimdiye kadar aşırı doz kullanımından herhangi bir ölüm rapor edilmemiş olmakla beraber, kullanıcılara LSD olarak 25-i NBOMe verilmesi sonucu ölümler olmuştur. Kromozomlarda ve beyinde yol açtığı hasarlar birçok araştırmaya konu olmuştur. LSD maddesinin esas riskleri çoğunlukla psikolojiktir. Akut negatif tecrübeler (bad trip – kötü yolculuk) LSD kullanımı ile anılan en belirgin sorundur. Kötü yolculuklar ilk kez kullananlarda olasıdır. Özellikle uygun olmayan mekanlarda doz ayarlaması yanlış yapılarak yaşanır. Hoş olmayan ve korkunç tecrübeler daha çok kullanan kişi zaten tedirgin (örneğin neler olacağı üzerine) veya melankolik ise yaşanmaktadır. Böyle bir kimse paniğe kapılabilir ve paronaya yaşar. Özellikle yabancı, yoğun veya karışık ortamlarda tetiklenmesi daha sık görülür. LSD merak edilir ve özenilecek etkisi göz önünde bulundurulduğunda kayıtlara geçen kötü yolculukların sayısı 1960’lı yılların medya konusu olmasıyla büyük oranda artmıştır. Kötü yolculuk tecrübeleri, medyanın ilgisinin 1960’ların sonuna doğru gittikçe azalmasıyla beraber düşmüştür. Diğer yandan 1970’li yıllarda LSD kullananların sayısı artmaya devam etmiştir. LSD kullanımı çoğu zaman önceden tahmin edilemeyen ve önemsenmesi gereken bir çıldırma riskiyle beraber anılmaktadır. Bunun yanında kalıcı beyin yıpranmaları da küçümsenmeyecek risklerdendir. Klinik araştırmalar incelendiğinde, kronik problemsel etkileri, yaşandığı takdirde, çoğunlukla zaten var olan, madde alımından önce de mevcut psikolojik sorunlardan kaynaklanmaktadır. Nadir de olsa bir LSD fenomeni “flashback” (geriye dönüş) halen hafife alınmayacak kadar kötü sonuçlar yaratmaktadır. Genellikle yaşanan veya korkulan geriye dönüş tecrübeleri çoğunlukla abartılı olsalar da bazı kullanıcılarda görülen “Halüsinasyonların sebep olduğu algılama bozukluğu” üzerine çalışmalar devam etmektedir. Yapılan detaylı araştırmalarda LSD kullanıcılarının şiddetli patlamalara ve garip davranışlara eğilimleri ortaya çıkmıştır. Uçacaklarına inanarak binaların tepelerinden atlayabilirler. Kör olana kadar güneşe bakabilir, gözlerini yuvalarından çıkarabilir ve hatta cinayet işleyebilirler. Ayrıca, 1 gram LSD 10.000 doz için yeterlidir. Bir toplu iğne başı kadar LSD; kullanan şahsın kendisinden geçmesini sağlaması için yeterlidir.
Kullanımı : Sıvı olarak jelibon, şekerlere damlatılarak ortaya çıkmıştır ve LSD genellikle ağızdan (oral olarak) alınır. Elde edilen LSD örneklerinin kuvvetleri doz başı yirmi ile seksen mikro gram arasında değişiklik göstermektedir. Bazen “mikrodot” tabletler veya “windovsplains” jelatin formlarında bulunsalar da, LSD genellikle “kâğıt parça asit” olarak satılmaktadır. Farklı bir şekilde anlatmak gerekirse, mürekkeple yazı yazıldığında fazla mürekkebi emen kâğıt gibi renkli, parlak, çıkartma gibi veya emici kâğıt tabakalarında emdirilmiş olarak, renkli tabletler veya emici kâğıt şeklinde, su gibi renksiz sıvı ve ince jelatin karaleri şeklinde satılır. Son zamanlarda bant ya da çıkartma benzeri parçaların da işlendiği ortaya çıkmıştır, vücuda yapıştırılan bant LSD'nin vücut ısısı etkisiyle kana karışması sonucu etkisini gösterir. LSD’nin sokaktaki veya zamana göre değişik formlarını tanımlamak amacıyla her dozda ve tabakada değişik tasarımlar olduğu görülmüştür.
Kullanım işaretleri : Gözlemlenebilen etkiler: göz bebeklerinin büyümesi, kalp atışındaki artış, kan basıncının artması ve vücut ısısının artması, terleme, iştah kaybı, uyku, ağız kuruması ve titreme olarak belirtilebilir. Bazı kişiler, LSD’nin etkisi altında iken çok değişken duygusal tepkiler de verebilir. Diğer kişiler ile konuşmada ve ilişkide zorlanmalar görülebilecek diğer etkilerdendir. Ayrıca beyinde serotonin hormonunun salınımına sebep olduğundan dolayı serotonin hormonları kaslara etki eder ve bunun sonucu kullanıcılar etkisindeyken çene kaslarının aşırı kasılması sonucu ağızlarını sıkı tutarlar, diğer vücut kaslarında uyuşukluk da görülür.
Plütonyum
Plütonyum 1 gramı: 4000 dolarPlütonyum, 1940 yılında Glenn T. Seaborg, Edwin M. McMillan, J. W. Kennedy ve A. C. Wahlby tarafından 152 cm'lik siklotron (atom hızlandırıcısı) içerisindeki uranyumun döteryum ile bombardımanı sonucunda elde edilmiştir.
Bütün izotopları radyoaktif ve toksiktir. Yapay olarak elde edilen plütonyum, Dünya'da bilinen en toksik elementtir. 238U çekirdeğinin nötron yakalaması ile 239U elde edilir. 239U beta bozunması ile nükleer reaktör içerisinde 239Pu (239Np ile birlikte) elde edilir.
Transuranyum serisi elementlerinin ikincisi, sun’i olarak yapılabilen radyoaktif bir element. Sembolü Pu, atom ağırlığı 244 ve atom numarası 94’tür. Plutonyum-238 izotopu; uranyum-235 izotopunun nötron bombardımanı ile, 1940 yılında, Kaliforniya Üniversitesinde Glenn T. Seaborg ve çalışma arkadaşları tarafından elde edildi. Bu tarihten sonra plutonyum, nükleerreaktör ve silahlarda kullanılmaya başlanmıştır
Plutonyum gümüş görünümünde metal olup, 639,85 °C’de erir ve 3230 °C’de kaynar. Özgül ağırlığı 19,8 g/cm 3 tür. Plutonyum aktinitler serisine dahil olup, diğer aktinitler gibi toprakta nadir bulunur. Plutonyum; gümüş, alüminyum, berilyum, kobalt, demir, mangan ve nikelle alaşım meydana getirebilir. Birçok plutonyum bileşikleri yapılmıştır.
İzotopları: Plutonyuma uranyum cevherleri içerisinde eser miktarda rastlanır. Bu bakımdan reaktör ve laboratuvarlarda kullanılabilmesi için sun’i olarak üretilmesi gerekir. Kütle numaraları 232’den 246’ya kadar değişen en az 15 izotopu yapılabilmektedir. Bunların içinde en önemlisi Pu-239 izotopudur. Nükleer reaktörlerde tabii uranyum-238 izotopu nötron bombardımanına tabi tutulursa uranyum-239 elde edilir. Bu izotopun iki defa ß ışıması yapması sonucu plutonyum-239 elde edilir. Pu-239 izotopunun yarılanma süresi 24.360 senedir ve alfa ışını yayarak uranyum 235 izotopu haline dönüşür. Diğer mühim izotoplarından Pu-238 yarılanma süresi 86,4 sene, Pu-244 ise 76 milyon sene olup, Alfa ışıması yaparak yarılanırlar.
Kullanılışı: Pu-239’un fisyon (bölünme) özelliğine sahip olması ve nükleer reaktörlerde yan ürün olarak elde edilebilmesi, bunun atom ve hidrojen bombaları için nükleer patlayıcı olarak kullanılmasına imkan sağlamaktadır. 1945 senesindeNagazaki’de patlatılan atom bombası Pu-239 izotopundan yapılmıştı.
Hafif su soğutmalı nükleer reaktörlerde senede 225 Kg Pu-239 yan ürün olarak elde edilir. Bu yan ürün normal olarak tekrar işleme sokularak plutonyum oksit ve uranyum oksit ihtiva eden yakıt çubukları olarak reaktörlerde kullanılabilir. Pu-239’un sıvı-metal soğutmalı nükleer reaktörlerde kullanılması programlanmaktadır. Pu-238’in alfa ışını yayarken çıkardığı ısı, Apollo uzay araçlarında elektrik üretimi maksadı ile kullanılmıştır. Pu-238 sun’i kalp yapım çalışmalarında da kullanılmaktadır. Pu-242 ve Pu-244’ün tıp ve metalurjide kullanma sahaları vardır.
Yapılışı: Plutonyumu, reaktördeki radyasyon veren diğer maddelerden ayırmak ve saflaştırmak için çeşitli kimyasal işlemlere başvurulur. Uranyum ve plutonyum ihtiva eden reaktörden plutonyumu ayırmak için karışım, nitrat asidi içinde çözülür. Burada plutonyum 6+ oksidasyon basamağına kadar yükseltgenir. Sonra hekzon (metil n-butil keton) ile karışımdan çekilip alınır. Bu işlemi alüminyum nitrat çözeltisiyle muamele takip eder. Alüminyum nitrat çözeltisi plutonyumu (3+) oksidasyon kademesine indirir. Saf plutonyum elde edilmesi için oksitleme işlemi birkaç defa tekrarlanır.
İnsan üzerindeki etkisi: Plutonyum çok zehirlidir. Deri üzerindeki bir yaraya mikrogram miktarı temas ederse kansere sebep olur. Plutonyum zerrecikleri havada kolayca askıda kalabildiği için, teneffüs yolu ile ciğerlere alınabilir. Plutonyum ciğer kanserine sebep olur. Vücut içerisine girer girmez, kemik maddesine hücum ederek kemik kanserine de sebebiyet verebilir.
Çevreye etkisi: Nükleer santral reaktörlerinin artıkları bol miktarda plutonyum ihtiva ettiği için çok iyi muhafaza edilmelidir. Nükleer bomba denemeleriyle çevreye plutonyum artıkları yayılmış durumdadır. Her patlayacak atom bombası insanlığın felaketine ortam hazırlamaktadır.
- Sonraki Konu